Обнаружив ошибку на странице, выделите ее и нажмите Ctrl + Enter
Некоторые газы обладают сравнительно высокой температурой кипения, что дает возможность получить их в жидком состоянии даже в условиях домашней лаборатории. Как пример можно привести диоксид азота (Ткип = 21.1°С), бутан (Ткип = -0.5°С) и диоксид серы (Ткип = -10.0°С).
Принципиальная схема установки для сжижения газов довольно проста. Газ получают в колбе (1) с помощью подходящей реакции или берут из баллона. Далее газ проходит через U-образную трубку (2) с осушителем (например, хлористый кальций) и попадает во вторую U-образную трубку (4), опущенную в большой сосуд с охлаждающей смесью (3). В последней трубке газ частично конденсируется.
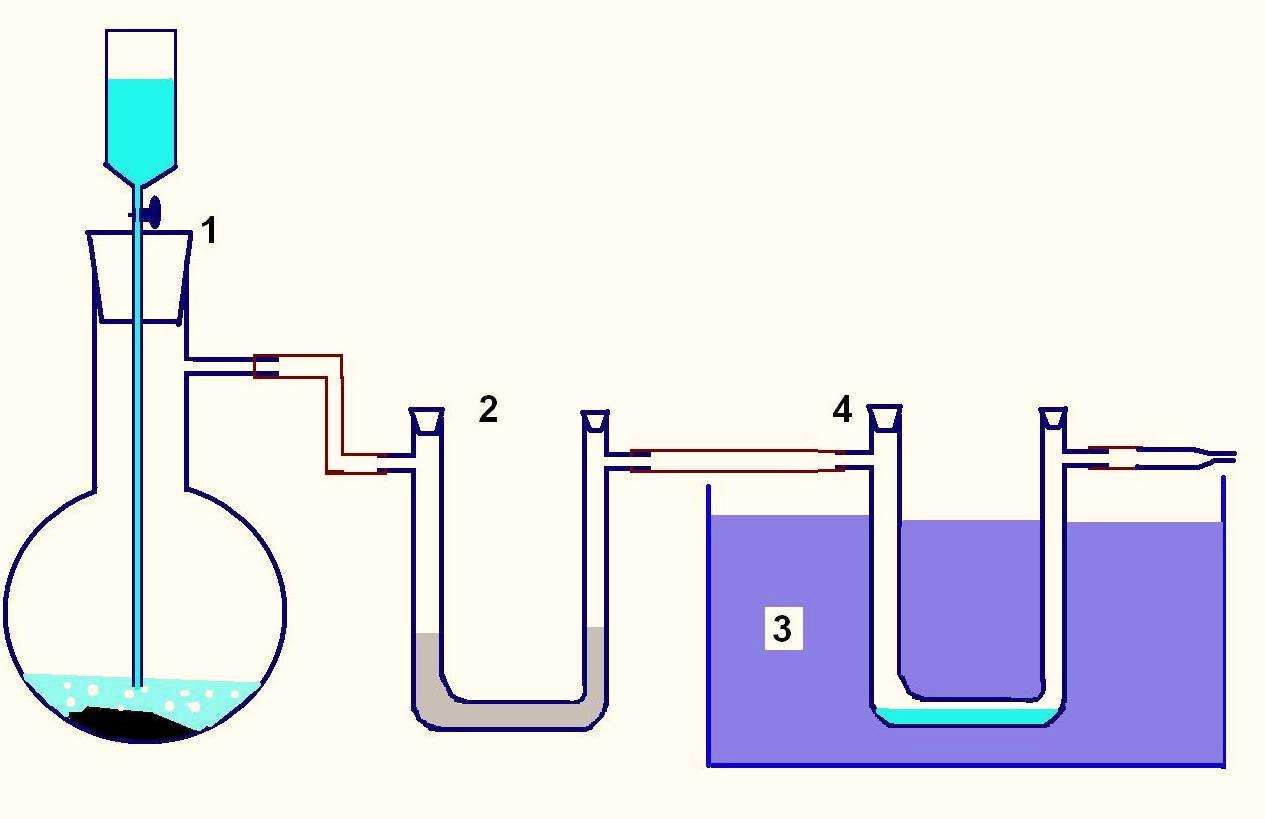
Схема установки для получения жидких газов
1 - колба для получения газа, 2 - U-образная трубка с осушителем (для простоты может быть опущена), 3 - охлаждающая смесь, 4 - U-образная трубка для конденсации газа.
Для начала рассмотрим, как готовить охлаждающие смеси.
1. Смесь 3 ч. снега (или измельченного льда) и 1 ч. поваренной соли позволяет достичь температуры -21°С. Если нужна более высокая температура, соотношение лед/соль изменяют.
__________________________________________________
1 Согласно книге П.И. Воскресенский Техника лабораторных работ [ссылка]
2. Смесь 1.5 ч шестиводного хлористого кальция CaCl2·6H2O с 1 ч. снега позволяет достичь температуры -55°С.
3. Смесь 1 ч. нитрата аммония и 1 ч. снега дает температуру до -20°С.
4. К диэтиловому эфиру, ацетону, бензину или спирту добавляют сухой лед (твердый углекислый газ). Смесь позволяет достичь температуры до -78°С.
5. Охлаждающими свойствами обладает смесь снега (льда) и концентрированной серной кислоты, однако эта смесь имеет преимущественно историческое значение, поскольку для серной кислоты можно найти более рациональное применение.
В описанных ниже экспериментах применялась смесь лед-соль в соотношении 3 ч. льда и 1 ч. соли. Компоненты смешали в пластмассовом лотке и перенесли смесь в стеклянную банку или стакан. Для подобных целей желательно использовать емкости из пластмассы, а еще лучше из пенопласта, поскольку эти материалы значительно менее теплопроводны, чем стекло. Однако в стеклянной банке или стакане опыт будет выглядеть более наглядно.
С виду банка с охлаждающей смесью лед-соль выглядит вполне обычно: словно кусочки льда плавают в воде, однако если в смесь опустить пробирку с водой, вода примерно через минуту замерзнет, в чем можно легко убедиться, вынув пробирку и перевернув ее отверстием вниз. Довольно скоро внешние стенки банки покроются изморозью - это конденсируется и замерзает влага из воздуха.
Принципиальная схема установки для сжижения газов довольно проста. Газ получают в колбе (1) с помощью подходящей реакции или берут из баллона. Далее газ проходит через U-образную трубку (2) с осушителем (например, хлористый кальций) и попадает во вторую U-образную трубку (4), опущенную в большой сосуд с охлаждающей смесью (3). В последней трубке газ частично конденсируется.
Схема установки для получения жидких газов
1 - колба для получения газа, 2 - U-образная трубка с осушителем (для простоты может быть опущена), 3 - охлаждающая смесь, 4 - U-образная трубка для конденсации газа.
Для начала рассмотрим, как готовить охлаждающие смеси.
Охлаждающие смеси
Известно много рецептов различных охлаждающих смесей. Однако химики, как правило, пользуются только несколькими из них. При выборе охлаждающей смеси большое значение имеет доступность компонентов. Наиболее доступные смеси, которые часто применяются в лаборатории, приведены ниже. 1. Смесь 3 ч. снега (или измельченного льда) и 1 ч. поваренной соли позволяет достичь температуры -21°С. Если нужна более высокая температура, соотношение лед/соль изменяют.
Зависимость температуры смеси лед-соль от ее состава [1]
| Содержание поваренной соли, % | Температура смеси, °С | ||
|
6 8 10 12 14 16 18 20 22 26 28 |
-3.5 -4.9 -6.1 -7.5 -9.0 -10.5 -12.1 -13.1 -15.7 -18.6 -19.3 |
__________________________________________________
1 Согласно книге П.И. Воскресенский Техника лабораторных работ [ссылка]
2. Смесь 1.5 ч шестиводного хлористого кальция CaCl2·6H2O с 1 ч. снега позволяет достичь температуры -55°С.
3. Смесь 1 ч. нитрата аммония и 1 ч. снега дает температуру до -20°С.
4. К диэтиловому эфиру, ацетону, бензину или спирту добавляют сухой лед (твердый углекислый газ). Смесь позволяет достичь температуры до -78°С.
5. Охлаждающими свойствами обладает смесь снега (льда) и концентрированной серной кислоты, однако эта смесь имеет преимущественно историческое значение, поскольку для серной кислоты можно найти более рациональное применение.
В описанных ниже экспериментах применялась смесь лед-соль в соотношении 3 ч. льда и 1 ч. соли. Компоненты смешали в пластмассовом лотке и перенесли смесь в стеклянную банку или стакан. Для подобных целей желательно использовать емкости из пластмассы, а еще лучше из пенопласта, поскольку эти материалы значительно менее теплопроводны, чем стекло. Однако в стеклянной банке или стакане опыт будет выглядеть более наглядно.
С виду банка с охлаждающей смесью лед-соль выглядит вполне обычно: словно кусочки льда плавают в воде, однако если в смесь опустить пробирку с водой, вода примерно через минуту замерзнет, в чем можно легко убедиться, вынув пробирку и перевернув ее отверстием вниз. Довольно скоро внешние стенки банки покроются изморозью - это конденсируется и замерзает влага из воздуха.








